? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 中美為何對瑞德西韋結論相反 曹彬:中國指標更嚴格
? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 2020-4-29? ?青野天潤
柳葉刀:瑞德西韋治療新冠中國重癥患者無顯著療效
靴子落地。
4月29日,頂尖醫(yī)學雜志《柳葉刀》在線正式發(fā)表了瑞德西韋第一項臨床試驗的數(shù)據(jù)結果。這是一項在中國湖北十家醫(yī)院開展的���,針對重癥新冠肺炎(COVID-19)患者的隨機�、雙盲�、安慰劑對照的多中心試驗����。
簡言之�����,這項臨床試驗結果顯示,與安慰劑相比��,接受瑞德西韋給藥治療并沒有顯著提高新冠肺炎患者的臨床改善時間��、死亡率或病毒清除時間���。
換句話說��,瑞德西韋的療效不明顯���。
同日,吉利德和美國國立衛(wèi)生研究院則同時發(fā)布公告稱其臨床試驗顯示瑞德西韋顯示出積極的效果���,且已達到其主要終點�。接受瑞德西韋治療的晚期患者康復速度快于接受安慰劑的患者�。
?

由于新冠肺炎至今沒有特效藥物,疫苗仍在路上�����,從1月末2月初開始的這場關于瑞德西韋有沒有效果的討論幾乎周周上熱門?��;仡櫼幌氯鸬挛黜f“成名史”�����,結果還是要靠嚴格的臨床試驗數(shù)據(jù)說話��。
“成名史”
瑞德西韋(Remdesivir)是一種核苷酸類似物���,一開始是吉利德公司針對埃博拉病毒開發(fā)的,但它對埃博拉的作用不明顯���。由于在體外和體內(nèi)動物模型中證明了對SARS和MERS等病毒病原體均有活性����,研究人員推測它對于此次的新冠肺炎也有效�����。
2020年1月19日��,一名由武漢返美的35歲男子在華盛頓州確診為新冠肺炎�,后醫(yī)生采用“同情用藥”的方式對其注射了瑞德西韋�,這名男子的臨床狀況得到大幅改善��,瑞德西韋“一戰(zhàn)成名”�。
當時正是中國疫情焦灼的時期,中國的研究人員立即著手在武漢開展瑞德西韋針對新冠肺炎的臨床試驗��。2月2日�,中日友好醫(yī)院發(fā)布公告稱:“中日友好醫(yī)院在武漢疫區(qū)牽頭開展瑞德西韋(Remdesivir)治療2019-nCoV新型冠狀病毒臨床研究�,為抗擊疫情帶來曙光?�!?/span>
中日友好醫(yī)院呼吸與危重癥醫(yī)學科主任曹彬團隊在武漢發(fā)起了兩項試驗���,根據(jù)ClinicalTrials.gov注冊信息顯示�����,針對重癥和輕中癥的兩項試驗注冊日期分別為2月6日和2月5日�����。其時預期結束時間為4月底���。
隨著疫情在全球的擴散�,瑞德西韋相繼在美國和全球其他疫情嚴重的國家展開臨床試驗���,其中既有研究者發(fā)起�����,也有吉利德自己發(fā)起的臨床試驗��。
在全球翹首以盼瑞德西韋“揭盲”的時候�,4月10日����,針對瑞德西韋在全球的進展,吉利德科學董事長兼首席執(zhí)行官Daniel O’Day發(fā)布了一封公開信��,稱目前瑞德西韋有七項臨床試驗已經(jīng)啟動�,預計在4月底獲得瑞德西韋針對重癥患者研究的初步數(shù)據(jù),但在中國“因入組停滯����,針對重癥患者的研究已停止?�!?/span>
同時吉利德在《新英格蘭醫(yī)學雜志》上發(fā)布一項瑞德西韋(remdesivir)針對重癥新冠病毒肺炎患者采用同情用藥(compassionate use)的治療結果。在接受同情使用瑞德西韋治療的嚴重Covid-19住院患者中���,在總共53例患者中���,有36例(68%)觀察到臨床改善。但缺乏對照組試驗�,數(shù)據(jù)存在局限性。
4月15日��,曹彬團隊更新了這兩項試驗在全球最大的臨床試驗登記中心上的信息����,重癥狀態(tài)更新為“終止”��,輕中癥狀態(tài)更新為“暫?!保碛删鶠椤癈OVID-19的流行在中國已經(jīng)得到很好的控制����,目前沒有符合條件的患者可以被納入?����!?/span>
由于瑞德西韋被寄予厚望,吉利德市值在2020年一季度上漲14.5%�����,股價觸及新高�����。
戲劇性始于一周前的4月23日���,由于世衛(wèi)組織的一次“誤操作”讓中國臨床試驗結果提前意外曝光�,稱其療效令人失望�����,本來走勢良好的吉利德當天股價盤中突然跳水�,一度下探超過8%,收跌4.34%����。
這項試驗即為此次《柳葉刀》發(fā)布的結果。當天吉利德全球首席醫(yī)療官Merdad Parsey代表公司緊急發(fā)布聲明稱�����,“我們認為那篇文章包含了對研究的不恰當描述。由于入組率低���,該研究被提前終止����,因此�����,它的數(shù)據(jù)不足以支撐有統(tǒng)計意義的結論��?�!?/span>
一周后�����,《柳葉刀》發(fā)布了曹彬團隊的“不盡如人意”的試驗結果�����,而美國國立衛(wèi)生院和吉利德堅持稱瑞德西韋仍舊有效果��。
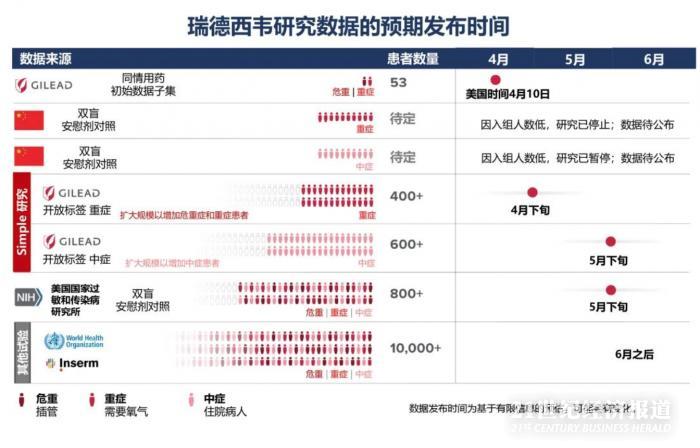
根據(jù)吉利德發(fā)布的時間表�����,后續(xù)還有多項臨床試驗將公布結果����。
?
曹彬團隊在中國湖北的十家醫(yī)院進行了一項隨機、雙盲�、安慰劑對照的多中心試驗。符合條件的患者是入院后經(jīng)實驗室確診的SARS-CoV-2感染的成年人(≥18歲)�,從癥狀發(fā)作到入組間隔為12天或更短,室內(nèi)空氣或血液中氧飽和度不超過94%�,動脈血氧分壓與吸入氧分壓不超過300 mm Hg的比率,以及放射學確定的肺炎��。
而后隨機將患者以2:1的比例隨機分配給瑞德西韋靜脈注射(第1天200 mg���,然后在第2-10天100 mg����,每日一次輸注)��,或相同劑量的安慰劑輸注10天�����。允許患者同時使用lopinavir–ritonavir��,干擾素和皮質類固醇�。
主要臨床終點是隨機分組后28天內(nèi)達到臨床改善的時間��。臨床改善被定義為按六點順序量表將患者的入院狀況降低兩點����,或從醫(yī)院實時出院����,以先到者為準。
六點量表如下:死亡= 6���;體外膜氧合或機械通氣入院= 5; 無創(chuàng)通氣或高流量氧氣療法入院= 4���;氧氣治療入院(但不需要大流量或無創(chuàng)通氣)= 3;入院但不需要氧氣治療= 2; 并已出院或已達到出院標準(定義為臨床恢復即發(fā)熱正常�,呼吸頻率<每分鐘24次呼吸,室內(nèi)空氣中的外周血氧飽和度> 94%���,和咳嗽緩解,均維持至少72 h)= 1��。
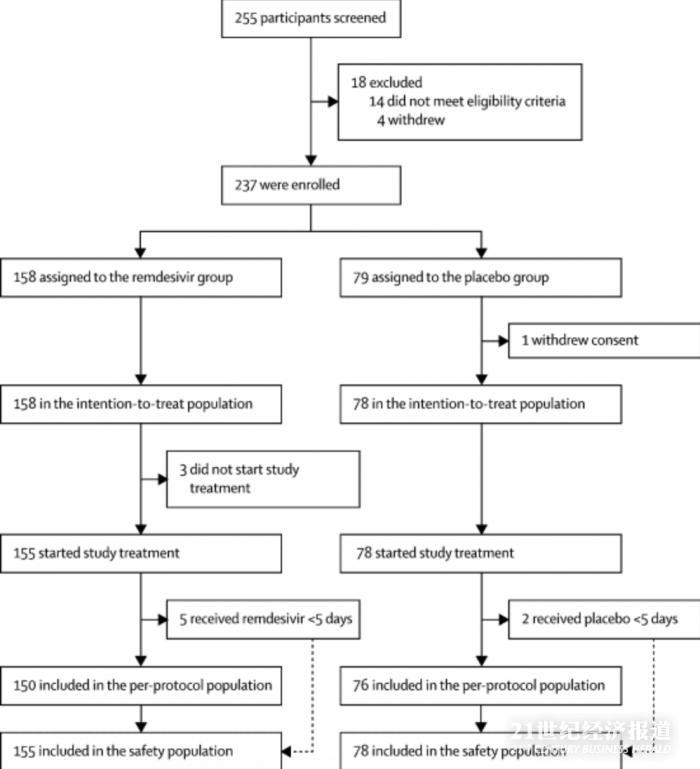
在2020年2月6日至2020年3月12日之間,篩選了255位患者�����,其中237位符合條件入組��。158例患者接受了瑞德西韋治療���,79例接受了安慰劑治療�。安慰劑組中的一名患者在隨機分組后撤回了先前書面知情同意書���,因此意向治療患者群(ITT)中包括158名和78名患者����。
3月12日之后���,由于武漢市爆發(fā)疫情得到控制��,并且沒有根據(jù)方案中指定的終止標準��,因此沒有患者入組�����。數(shù)據(jù)安全和監(jiān)控委員會建議終止研究�����,并于3月29日對數(shù)據(jù)進行分析�����。
?
結果顯示����,使用瑞德西韋與改善臨床療效的時間無關(HR=1.23, 95% CI���,0.87-1.75)���。兩組的28天死亡率相似(瑞德西韋組22例死亡[14%]安慰劑組為10(13%);差1?1%[95%CI -8?1至10?3])��。但在癥狀持續(xù)時間為10天或更短的患者中��,接受瑞德西韋治療的患者在臨床上改善的時間要比接受安慰劑治療的患者快得多(HR=1.52�,95% CI,0.95-2.43)���。
在155名接受瑞德西韋治療的患者有102名(66%)發(fā)生不良事件�����,78名安慰劑接受者中有50名(64%)發(fā)生不良事件����。瑞德西韋組最常見的不良反應是便秘��,低白蛋白血癥����,低鉀血癥,貧血��,血小板減少和總膽紅素升高�。在安慰劑組中,最常見的是低白蛋白血癥����,便秘,貧血�����,低鉀血癥,天冬氨酸轉氨酶升高���,血脂升高和總膽紅素升高���。
研究人員認為,在這項針對重度新冠患者住院的成年患者的研究中����,瑞德西韋沒有表現(xiàn)出統(tǒng)計學上顯著的臨床獲益。然而�����,較早治療者中臨床改善時間的數(shù)量減少需要更大的研究證實����。
盡管在冠狀病毒感染的臨床前模型中顯示出強大的抗病毒作用,但在本研究中��,瑞德西韋沒有導致SARS-CoV-2 RNA載量或上呼吸道或痰標本的可檢測性顯著降低�。研究發(fā)現(xiàn)瑞德西韋具有足夠的耐受性,未發(fā)現(xiàn)新的安全隱患����。此外��,對于重度新冠患者�����,更長的療程和更高劑量的瑞德西韋是否有益,尚無答案��。
吉利德和NIH的說法
更具有戲劇性的是����,4月29日,吉利德和美國國立衛(wèi)生研究院(NIH)下屬美國國家過敏和傳染病研究所(NIAID)分別發(fā)公告稱其所開展的瑞德西韋臨床試驗顯示出積極效果����。
吉利德宣布的是一項開放標簽的3期SIMPLE試驗的主要結果,該試驗評估了住院嚴重COVID-19疾病患者接受瑞德西韋5天和10天給藥時間的結果:瑞德西韋5天給藥方案較10天給藥方案顯示出相似的臨床改善��。并且��,越早接受瑞德西韋治療的患者臨床改善情況越好(發(fā)病10天內(nèi)和10天后接受治療的患者第14天出院比例分別為62%和49%)�。
NIAID的研究則是一項涉及1063名患者的隨機對照試驗的初步數(shù)據(jù)分析,該試驗從2月21日開始��,接受瑞德西韋的新冠肺炎晚期住院患者的康復速度快于接受安慰劑的類似患者。
負責監(jiān)督試驗的獨立數(shù)據(jù)和安全監(jiān)視委員會(DSMB)于4月27日舉行會議�����,以審查數(shù)據(jù)并與研究小組共享其中期分析結果��?����;趯?shù)據(jù)的審查�,他們指出,從主要終點���、恢復時間(這是流感試驗中常用的一種指標)的角度來看���,瑞德西韋優(yōu)于安慰劑。本研究中的恢復被定義為足以出院或恢復正?����;顒铀?��。
初步結果表明���,接受瑞德西韋的患者的康復時間比接受安慰劑的患者快31%(p <0.001)��。接受瑞德西韋治療的患者的中位恢復時間為11天�����,而接受安慰劑的患者為15天��。結果還顯示了生存益處����,接受瑞德西韋組的死亡率為8.0%�,而安慰劑組的死亡率為11.6%(p = 0.059)���。
受該消息提振���,吉利德當日盤中大漲超過8%,市值過千億美元�。也有華爾街分析師認為,F(xiàn)DA可能會因此加速批準瑞德西韋上市��。
?

吉利德:瑞德西韋美國試驗達終點 結果數(shù)據(jù)積極
4月29日�,吉利德官網(wǎng)公布新的關于瑞德西韋臨床試驗結果。
吉利德科學公司關于美國過敏和傳染病研究所研究抗病毒藥物瑞德西韋用于COVID-19的積極數(shù)據(jù)的聲明。
吉利德了解到來自美國過敏和傳染病研究所(NIAID)對抗病毒藥物瑞德西韋治療COVID-19的研究得出的積極數(shù)據(jù)�。我們了解該試驗已達到其主要終點,并且NIAID將在即將舉行的簡報中提供詳細信息����。
Remdesivir尚未在全球任何地方獲得許可或批準,并且尚未被證明對COVID-19的治療是安全或有效的��。吉利德不久后將在該公司的開放標簽3期SIMPLE試驗中與重度COVID-19疾病患者共享其他remdesivir數(shù)據(jù)���。這項研究將提供信息����,說明較短的5天治療時間是否具有與NIAID試驗和其他正在進行的試驗中評估的10天治療療程相似的療效和安全性��。吉利德(Gilead)預計第二次SIMPLE研究將在5月底評估中度COVID-19疾病患者的remdesivir的5天和10天給藥時間�。
吉利德將繼續(xù)與監(jiān)管機構討論有關瑞德西韋作為COVID-19潛在治療藥物的數(shù)據(jù)集。
?

中美為何對瑞德西韋結論相反 曹彬:中國指標更嚴格
VIA:第一財經(jīng)
權威醫(yī)學期刊《柳葉刀》4月29日發(fā)表了全球首項關于吉利德在研抗病毒藥物瑞德西韋的隨機雙盲對照組����、多中心臨床試驗論文,顯示瑞德西韋對于重癥患者無顯著療效���。
權威醫(yī)學期刊《柳葉刀》4月29日發(fā)表了由瑞德西韋中國臨床試驗負責人�����、中日友好醫(yī)院副院長曹彬教授和北京協(xié)和醫(yī)學院院校長王辰院士所寫的�,關于全球首項關于吉利德在研抗病毒藥物瑞德西韋的隨機雙盲對照組、多中心臨床試驗論文��,顯示瑞德西韋對于重癥患者無顯著療效�。
同一天吉利德科學公司發(fā)布其針對397名患者的開放標簽臨床III期試驗結果顯示,瑞德西韋早期治療效果顯著���,超過一半患者在兩周內(nèi)出院���。
美國國家過敏與傳染病研究所(NIAID)所長安東尼?福奇當天表示,瑞德西韋臨床試驗數(shù)據(jù)積極���,顯著縮短了病人恢復的時間,將成為新冠治療的新標準����。
針對中美臨床試驗為何出現(xiàn)截然相反的結果,瑞德西韋中國臨床試驗負責人曹彬教授向第一財經(jīng)記者獨家表示�����,研究終點不同導致了結果的差異,中國的研究設計更嚴格��。
《柳葉刀》最新發(fā)表的瑞德西韋首項臨床試驗論文的通訊作者為中日友好醫(yī)院副院長曹彬教授和北京協(xié)和醫(yī)學院院校長王辰院士�。在對2月6日至3月12日期間招募的237名來自武漢10家醫(yī)院的重癥患者進行臨床試驗后,研究作者通過預先確定的臨床試驗主要終點得出結論���,瑞德西韋用藥與臨床癥狀的改善關系不大��。
從28天死亡率來看�����,瑞德西韋組和對照組分別為14%和13%�;兩組的副作用比例分別為66%和64%�����。此外�����,臨床試驗結果還顯示臨床癥狀改善的風險率(HR)為1.23�。
論文稱,盡管沒有統(tǒng)計學顯著性�����,但是根據(jù)預先確定的次要終點發(fā)現(xiàn),與標準治療的安慰劑組相比����,接受瑞德西韋治療的患者在出現(xiàn)癥狀后的10天內(nèi)臨床改善時間和有創(chuàng)機械通氣時間縮短。
“次要終點和亞組分析不能改變研究的主要結論���?�!辈鼙蚪淌谠谡撐陌l(fā)表后對第一財經(jīng)記者表示�。
曹彬教授向第一財經(jīng)記者指出����,這是一項設計合理的雙盲、安慰劑對照�����、多中心隨機試驗����。項目執(zhí)行過程非常嚴格�,極少失訪�。臨床試驗結果表明�,與安慰劑對照組相比,未觀察到瑞德西韋可以加快住院患者的病情恢復或降低死亡率�����。此外�,病毒學方面,與安慰劑對照組相比�,未觀察到瑞德西韋可更快降低上、下呼吸道標本中的病毒載量����。
基于上述結論,研究作者認為��,今后的研究需要確定瑞德西韋在更早期����、更高劑量或與其他抗病毒藥或新冠保護性抗體聯(lián)合治療重癥患者是否有效。
瑞德西韋中國臨床試驗設計入組重癥患者453名�,但最終因入組樣本數(shù)量不足,試驗于4月16日提前終止���。
《柳葉刀》在發(fā)表瑞德西韋中國臨床試驗論文時�,同時刊登了一篇由愛丁堡大學醫(yī)療數(shù)據(jù)主席約翰?諾里(John Norrie)教授撰寫的題為《動力不足的臨床研究的挑戰(zhàn)》的評論文章。
諾里教授指出:“缺乏足夠的臨床試驗數(shù)據(jù)的支撐意味著試驗的發(fā)現(xiàn)不具有結論性意義���。但在大流行病的背景下����,數(shù)據(jù)分享尤其重要��,能夠快速管理相關的數(shù)據(jù)集�。”
他還強調����,高質量的隨機試驗的重要性,認為必須嚴格確認或者駁斥觀察性數(shù)據(jù)釋放出的積極信號����,尤其是在疾病療法的安全性和有效性尚未被驗證的情況下。
研究終點不同導致相反結論
就在《柳葉刀》發(fā)表瑞德西韋中國臨床數(shù)據(jù)的同一天��,4月29日�����,吉利德科學公司向外釋放積極信號����,公布了兩個好消息,一是來自美國國立衛(wèi)生研究院(NIH)的臨床試驗已經(jīng)達到主要終點��,并且數(shù)據(jù)正面����;二是公布了吉利德開放標簽的臨床試驗,顯示至少一半患者接受治療5天后臨床癥狀改善�����、出院�,并且接受5天用藥和10天用藥療效相似。除意大利外���,兩組患者14天死亡率都只有7%��。
?
美國NIH對全球大約1090名患者展開的隨機雙盲對照臨床試驗顯示����,31%的患者在用藥后癥狀出現(xiàn)改善���。瑞德西韋治療組的恢復時間為11天���,對照組的恢復時間是15天���;瑞德西韋組的死亡率是8%,對照組的死亡率是12%�����。NIAID所長福奇承認��,死亡率的改善沒有達到預期���。
針對中美臨床試驗的結論為何出現(xiàn)截然相反的結果��,曹彬教授對第一財經(jīng)記者表示:“我們對用藥時機有要求��,時間窗口在癥狀出現(xiàn)后的12天以內(nèi)����,但最主要的不同是研究終點的不同��,美國NIH的研究終點指標過松����。如果我們使用這一指標����,估計也是陰性結果�����?����!?/span>
美國NIH和中國發(fā)表在《柳葉刀》的研究與設計均為雙盲安慰劑對照臨床(RCT)���,用藥方案相同?�!暗强陀^講�,中國瑞德西韋研究設計更加嚴格,科學性更強��?!辈鼙蚪淌诟嬖V第一財經(jīng)記者。
從主要終點來看�����,美國NIH設計的指標為臨床恢復時間,中國則是設計了基于6分量表的臨床改善時間���?���!癗IH的恢復定義比較寬泛����,包括住院,但不需要氧療�����、出院(但可能仍有活動受限���、需要吸氧)��,相當于我們的1-2級+回家吸氧����?��!辈鼙蚪淌诒硎?。
前美國FDA局長斯科特?戈特利布(Scott Gottlieb)表示:“瑞德西韋更像是新冠疾病治療工具箱中的一部分,它不是特效藥�����,但是如果能在患者感染的早期使用���,可能會對控制疾病的發(fā)展有好處?���!?/span>
新冠病毒全球確診感染人數(shù)已經(jīng)超過300萬,死亡人數(shù)接近22萬�。在疫苗研發(fā)結果仍然需要等待相當長時間前,找到有效藥物對控制疫情是至關重要的��。
在這樣的背景下����,市場顯然更愿意接受好消息。受吉利德宣布的臨床試驗結果提振���,4月29日美股開盤后����,吉利德在短暫停牌后,大漲近10%����,吉利德近三個月股價漲幅超過30%。